
विषय
- शारीरिक परीक्षा और इतिहास
- रक्त परीक्षण
- अस्थि मज्जा आकांक्षा और बायोप्सी
- Cytochemistry
- गुणसूत्र और जीन अध्ययन
- अन्य प्रक्रियाएं
- इमेजिंग
- विभेदक निदान
- मचान
कोशिकाओं (प्रवाह साइटोमेट्री) के साथ-साथ आनुवंशिक परिवर्तन (साइटोजेनेटिक परीक्षण) पर सतह मार्करों की तलाश के लिए अतिरिक्त परीक्षण किए जाते हैं। कुछ ल्यूकेमिया के साथ, एक काठ का पंचर (स्पाइनल टैप), या लिम्फ नोड बायोप्सी के रूप में अच्छी तरह से उपयोग किया जा सकता है।
यदि कैंसर का पता लगाया जाता है, तो लक्षणों के आधार पर मंचन किया जाता है जैसे कि लक्षण, ल्यूकेमिया का उपप्रकार, रक्त या अस्थि मज्जा में असामान्य कोशिकाओं की संख्या, और बहुत कुछ।
जब ल्यूकेमिया निदान के बारे में बात की जाती है, तो यह याद रखना महत्वपूर्ण है कि ल्यूकेमिया एक बीमारी या चार बीमारियां नहीं है। बल्कि, कई अलग-अलग विविधताएं हैं।
माइक्रोस्कोप के तहत समान दिखने वाले दो ल्यूकेमिया बहुत अलग तरीके से व्यवहार कर सकते हैं, और नीचे दिए गए कुछ परीक्षण कुछ अंतरों को अलग करने में मदद कर सकते हैं।
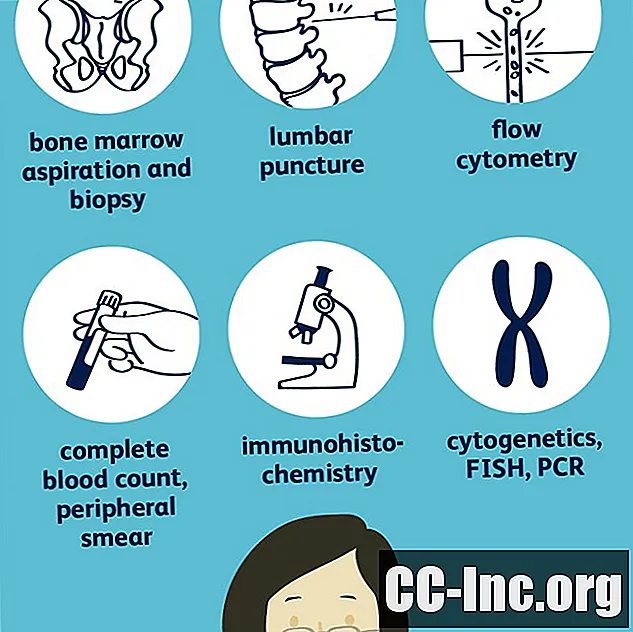
शारीरिक परीक्षा और इतिहास
इतिहास और शारीरिक ल्यूकेमिया के निदान में शुरुआती बिंदु हैं और जो अक्सर डॉक्टरों को आगे के अध्ययन का आदेश देने के लिए प्रेरित करते हैं, लेकिन निदान करने के लिए उनका उपयोग अकेले नहीं किया जा सकता है।
यदि ल्यूकेमिया का संदेह है, तो आपका डॉक्टर ल्यूकेमिया के किसी भी लक्षण और उस बीमारी के जोखिम कारकों के बारे में पूछेगा जो आपके पास हो सकती है। एक शारीरिक परीक्षा से संकेत मिल सकता है कि ल्यूकेमिया मौजूद हो सकता है, जैसे कि लिम्फ नोड्स की सूजन, पीली त्वचा, या चोट लगना। हालांकि मौजूद होने पर वे अन्य चिंताओं का संकेत दे सकते हैं। आपका डॉक्टर उनकी उपस्थिति को ध्यान में रखेगा।
ल्यूकेमिया डॉक्टर चर्चा गाइड
अपने अगले डॉक्टर की नियुक्ति के लिए हमारे प्रिंट करने योग्य मार्गदर्शिका प्राप्त करें जिससे आपको सही सवाल पूछने में मदद मिल सके।

रक्त परीक्षण
दोनों पूर्ण रक्त गणना और परिधीय स्मीयर, सरल रक्त परीक्षण, निदान और ल्यूकेमिया के प्रकार के रूप में महत्वपूर्ण सुराग दे सकते हैं, और आगे मूल्यांकन का मार्गदर्शन कर सकते हैं।
पूर्ण रक्त कोशिका गणना और परिधीय रक्त स्मीयर
एपूर्ण रक्त गणना (CBC) अस्थि मज्जा द्वारा बनाई गई प्रत्येक प्रमुख प्रकार की रक्त कोशिकाओं की संख्या को मापता है: श्वेत रक्त कोशिकाएं, लाल रक्त कोशिकाएं और प्लेटलेट्स। CBC उन परिणामों को भी दे सकता है जो इन कोशिकाओं के बारे में महत्वपूर्ण जानकारी को रिले करते हैं, जैसे कि लाल रक्त कोशिकाएं बड़ी या छोटी होती हैं।
जबकि अक्सर ल्यूकेमिया के साथ सफेद रक्त कोशिकाओं में वृद्धि होती है, तीव्र ल्यूकेमिया के साथ कभी-कभी होता है कमी रक्त कोशिकाओं के सभी प्रकारों में, एक स्थिति जिसे पैन्टीटोपेनिया कहा जाता है।
ए परिधीय धब्बा ल्यूकेमिया के निदान पर विचार करते समय एक बहुत महत्वपूर्ण परीक्षण है। परिधीय स्मीयर में, रक्त का एक नमूना माइक्रोस्कोप स्लाइड पर फैलाया जाता है और डाई जोड़ा जाता है। स्मीयर का मूल्यांकन एक माइक्रोस्कोप के तहत किया जाता है।
एक सीबीसी यह निर्धारित कर सकता है कि क्या सफेद रक्त कोशिका की संख्या कम या अधिक है, लेकिन सफेद रक्त कोशिकाओं के प्रकार के बारे में पर्याप्त जानकारी नहीं दी जाती है जो बढ़ी या कम हो जाती हैं।
यह एक डॉक्टर को यह भी नहीं बताता है कि क्या परिधीय रक्त कोशिकाओं में "धमाकों" नामक अपरिपक्व श्वेत रक्त कोशिकाएं हैं जो सामान्य रूप से केवल अस्थि मज्जा में महत्वपूर्ण संख्या में पाई जाती हैं।
एक परिधीय स्मीयर माइक्रोस्कोप के तहत कोशिकाओं का निरीक्षण करने के लिए तकनीशियनों और डॉक्टरों को सीधे अनुमति देकर इन सवालों का जवाब दे सकता है।
सीबीसी पर विशिष्ट निष्कर्ष (ये अलग-अलग हो सकते हैं) और चार मुख्य प्रकार के ल्यूकेमिया के लिए रक्त स्मीयर में शामिल हैं:
रोग | सीबीसी परिणाम | रक्त स्मीयर के परिणाम |
एक्यूट मायलोजेनस ल्यूकेमिया (AML) | लाल कोशिकाओं और प्लेटलेट्स की सामान्य मात्रा से कम | कई अपरिपक्व श्वेत कोशिकाएं, और कभी-कभी एयूआर छड़ की उपस्थिति |
तीव्र लिम्फोसाईटिक ल्यूकेमिया (ALL) | लाल कोशिकाओं और प्लेटलेट्स की सामान्य मात्रा से कम | कई अपरिपक्व सफेद कोशिकाएं |
क्रोनिक माइलोजेनस ल्यूकेमिया (CML) | • लाल रक्त कोशिका की गिनती अधिक हो सकती है और प्लेटलेट की गिनती अधिक या कम हो सकती है | • कुछ अपरिपक्व श्वेत कोशिकाओं को दिखा सकते हैं |
क्रोनिक लिम्फोसाइटिक ल्यूकेमिया (CLL) | • लाल कोशिकाएं और प्लेटलेट्स कम हो सकते हैं या नहीं हो सकते हैं | • छोटी या कोई अपरिपक्व श्वेत कोशिकाएँ |
नीचे दिए गए कुछ परीक्षणों, जैसे कि साइटोकैमिस्ट्री, परिधीय रक्त पर भी किया जा सकता है।
अस्थि मज्जा आकांक्षा और बायोप्सी
अधिकांश प्रकार के ल्यूकेमिया के साथ, रक्त परीक्षण निर्णायक रूप से रोग का निदान करने के लिए पर्याप्त नहीं है, और एक अस्थि मज्जा आकांक्षा और बायोप्सी किया जाता है। (सीएलएल के साथ, निदान कभी-कभी उपरोक्त रक्त परीक्षणों के आधार पर किया जा सकता है, लेकिन एक अस्थि मज्जा अभी भी यह निर्धारित करने में मददगार हो सकता है कि कैंसर कितना उन्नत है।) अस्थि मज्जा ल्यूकेमिया और सभी में कैंसर कोशिकाओं का स्रोत है। परिधीय रक्त में रक्त कोशिकाएं पाई जाती हैं।
अस्थि मज्जा आकांक्षा के साथ, एक लंबी, पतली सुई को लिडोकेन के साथ स्थानीय रूप से त्वचा को सुन्न करने के बाद कूल्हे (या कभी-कभी स्तन की हड्डी) में अस्थि मज्जा में डाला जाता है। अस्थि मज्जा का एक नमूना महाप्राण होने के बाद, एक बायोप्सी नमूना भी लिया जाता है।
सामान्य अस्थि मज्जा में, 1 प्रतिशत से 5 प्रतिशत कोशिकाओं के बीच ब्लास्ट कोशिकाएं होती हैं, या अपरिपक्व श्वेत रक्त कोशिकाएं होती हैं जो सामान्य रूप से रक्त में पाए जाते हैं।
सभी का एक निदान किया जा सकता है अगर कम से कम 20% कोशिकाएं विस्फोट (लिम्फोब्लास्ट) हैं। एएमएल के साथ, एक निदान किया जा सकता है यदि कोई विशिष्ट गुणसूत्र परिवर्तन पाया जाता है, तो 20% से कम विस्फोट (मायलोब्लास्ट) होते हैं।
अस्थि मज्जा में मौजूद विभिन्न कोशिकाओं की संख्या को देखने के अलावा, डॉक्टर कोशिकाओं के पैटर्न को भी देखते हैं। उदाहरण के लिए, सीएलएल के साथ, रोग का पूर्वानुमान बेहतर है यदि कैंसर कोशिकाओं को समूहों (गांठदार या अंतरालीय पैटर्न) में पाया जाता है, अगर वे अस्थि मज्जा के आसपास बिखरे हुए पाए जाते हैं।
स्वस्थ रक्त बनाने वाली कोशिकाओं में ल्यूकेमिया कोशिकाओं का अनुपात नैदानिक प्रक्रिया में महत्वपूर्ण हो सकता है।
Cytochemistry
साइटोकेमिस्ट्री यह देखती है कि अस्थि मज्जा में कोशिकाएं किस तरह से कुछ धब्बे लेती हैं और एएमएल से सभी को अलग करने में सहायक हो सकती हैं। टेस्ट में फ्लो साइटोमेट्री और इम्यूनोहिस्टोकेमिस्ट्री दोनों शामिल हो सकते हैं।
में फ़्लो साइटॉमेट्री, अस्थि मज्जा कोशिकाओं (या परिधीय रक्त कोशिकाओं) को एंटीबॉडी के साथ लेपित किया जाता है ताकि कोशिकाओं की सतह पर पाए जाने वाले कुछ प्रोटीन की उपस्थिति हो सके। एंटीबॉडीज इन प्रोटीनों से चिपके रहते हैं और लेजर द्वारा पेश किए जाने पर वे प्रकाश से पता लगा सकते हैं।
इम्युनोहिस्टोकैमिस्ट्री समान है, लेकिन एंटीबॉडी-चिह्नित प्रोटीन द्वारा बंद प्रकाश को देखने के लिए लेजर का उपयोग करने के बजाय, उन्हें एक रंग परिवर्तन के कारण माइक्रोस्कोप के नीचे देखा जा सकता है।
कोशिकाओं की सतह पर अद्वितीय प्रोटीन की तलाश की इस प्रक्रिया को इस रूप में संदर्भित किया जाता है immunophenotyping। आनुवांशिकी में, जीनोटाइप जीन की विशेषताओं को संदर्भित करता है, जबकि फेनोटाइप भौतिक विशेषताओं (जैसे नीली आँखें) का वर्णन करता है। इन फेनोटाइप में विभिन्न प्रकार के ल्यूकेमिया भिन्न होते हैं।
तीव्र ल्यूकेमिया (सभी और एएमएल दोनों) के साथ, ये अध्ययन रोग के उपप्रकार को निर्धारित करने में सहायक हो सकते हैं, और सभी के साथ, यह निर्धारित कर सकते हैं कि क्या ल्यूकेमिया में टी कोशिकाएं या बी कोशिकाएं शामिल हैं।
इसके अलावा, ये परीक्षण सीएलएल (ZAP-70 और CD38 नामक प्रोटीन की तलाश करके) के निदान की पुष्टि करने में बहुत मददगार हो सकते हैं।
ल्यूकेमिया कोशिकाओं में डीएनए की मात्रा निर्धारित करने के लिए फ्लो साइटोमेट्री का उपयोग किया जा सकता है, जो उपचार की योजना बनाने में सहायक हो सकता है। एक औसत सेल की तुलना में अधिक डीएनए वाले सभी कोशिकाओं कीमोथेरेपी के लिए बेहतर प्रतिक्रिया देते हैं।
गुणसूत्र और जीन अध्ययन
प्रत्येक कोशिका के डीएनए में पाए जाने वाले गुणसूत्रों या जीनों में ल्यूकेमिया कोशिकाओं में अक्सर बदलाव होते हैं। हमारी कोशिकाओं में से प्रत्येक में आमतौर पर 46 गुणसूत्र होते हैं, प्रत्येक माता-पिता से 23, जिसमें कई जीन होते हैं। कुछ अध्ययन मुख्य रूप से क्रोमोसोमल परिवर्तनों को देखते हैं, जबकि अन्य विशिष्ट जीन में बदलाव की तलाश करते हैं।
सितोगेनिक क s
साइटोजेनेटिक्स में माइक्रोस्कोप के तहत कैंसर कोशिकाओं के गुणसूत्रों को देखने और असामान्यताओं की तलाश करना शामिल है।
जिस विधि के द्वारा यह किया जाता है (कैंसर कोशिकाओं को पुनः प्राप्त होने के बाद प्रयोगशाला में विकसित होने के लिए समय की आवश्यकता होती है) के कारण, अस्थि मज्जा बायोप्सी किए जाने के बाद इन अध्ययनों के परिणाम अक्सर दो से तीन सप्ताह तक उपलब्ध नहीं होते हैं।
ल्यूकोमिया कोशिकाओं में देखे जा सकने वाले क्रोमोसोमल परिवर्तनों में शामिल हैं:
- विलोपन: एक गुणसूत्र का हिस्सा गायब है।
- अनुवाद: दो गुणसूत्रों के टुकड़ों का आदान-प्रदान होता है। यह एक पूर्ण आदान-प्रदान हो सकता है, जिसमें डीएनए के टुकड़ों को केवल दो गुणसूत्रों या आंशिक एक के बीच स्वैप किया जाता है। उदाहरण के लिए, क्रोमोसोम 9 और 22 के बीच डीएनए की अदला-बदली की जा सकती है। क्रोमोसोम ट्रांसलोकेशन ल्यूकेमिया में बहुत आम है, ये कैंसर के 50 प्रतिशत तक होता है।
- उलटा: एक गुणसूत्र का हिस्सा मौजूद रहता है, लेकिन चारों ओर मोड़ दिया जाता है (जैसे कि एक पहेली का एक टुकड़ा हटा दिया जाता है और प्रतिस्थापित किया जाता है, लेकिन आगे की तरफ)।
- जोड़ या दोहराव: एक गुणसूत्र के सभी या हिस्से की अतिरिक्त प्रतियां मिलती हैं।
- ट्राईसोमी: दो के बजाय गुणसूत्रों में से एक की तीन प्रतियां होती हैं।
ल्यूकेमिया के प्रकार को और अधिक परिभाषित करने के अलावा, साइटोजेनेटिक्स नियोजन उपचार में मदद कर सकता है। उदाहरण के लिए, सभी में, 50 से अधिक गुणसूत्र वाले ल्यूकेमिया कोशिकाएं उपचार के लिए बेहतर प्रतिक्रिया देती हैं।
सीटू संकरण (फिश) में फ्लोरोसेंट
सीटू संकरण (फ़िश) में फ्लोरोसेंट एक ऐसी प्रक्रिया है जो गुणसूत्रों में परिवर्तन देखने के लिए विशेष रंजक का उपयोग करती है जिसे माइक्रोस्कोप के तहत पता नहीं लगाया जा सकता है, या विशिष्ट जीन में परिवर्तन हो सकता है।
क्रोनिक मायलोजेनस ल्यूकेमिया (सीएमएल) के साथ, यह परीक्षण की तलाश कर सकता है टुकड़े बीसीआर / एबीएल 1 फ्यूजन जीन (फिलाडेल्फिया गुणसूत्र)।
CML वाले मोटे तौर पर 95% लोगों में यह छोटा गुणसूत्र 22 होगा, लेकिन अन्य 5% में अभी भी आगे के परीक्षण पर असामान्य BCR / ABL1 फ्यूजन जीन होगा। फिलाडेल्फिया गुणसूत्र भी सभी के साथ एक महत्वपूर्ण खोज है।
सीएलएल के साथ, साइटोजेनेटिक्स कम सहायक होता है, और आनुवंशिक परिवर्तन खोजने में फिश और पीसीआर अधिक महत्वपूर्ण होते हैं।इन अध्ययनों में कई आनुवंशिक असामान्यताएं देखी जा सकती हैं, जिनमें क्रोमोसोम 13 की लंबी भुजा में विलोपन (रोग के साथ आधे लोगों में), गुणसूत्र 12 की एक अतिरिक्त प्रति (त्रिसंक्षण 12), 17 वीं और 11 वीं में विलोपन शामिल हैं। गुणसूत्र, और जीन जैसे NOTCH1, SF3B1, और अधिक में विशिष्ट उत्परिवर्तन।
पॉलिमरेज़ चेन रिएक्शन (पीसीआर)
मछली की तरह, पोलीमरेज़ चेन रिएक्शन (पीसीआर) गुणसूत्रों और जीनों में परिवर्तन पा सकता है जो साइटोजेनेटिक्स के माध्यम से नहीं देखा जा सकता है। पीसीआर उन बदलावों को खोजने में भी मददगार है जो कुछ ही कोशिकाओं में मौजूद हैं, लेकिन सभी नहीं, कैंसर कोशिकाओं के।
पीसीआर बीसीआर / एबीएल जीन को खोजने में बहुत संवेदनशील है, तब भी जब क्रोमोसोम परीक्षण पर सीएमएल के अन्य संकेत नहीं मिले हैं।
अन्य प्रक्रियाएं
रक्त और अस्थि मज्जा में सफेद रक्त कोशिकाओं के मूल्यांकन के अलावा, कभी-कभी अन्य प्रक्रियाएं की जाती हैं।
काठ का पंचर (स्पाइनल टैप)
कुछ प्रकार के ल्यूकेमिया के साथ, एक स्पाइनल टैप (काठ का पंचर) ल्यूकेमिया कोशिकाओं की उपस्थिति को देखने के लिए किया जा सकता है जो मस्तिष्क और रीढ़ की हड्डी के आसपास के द्रव में फैल गए हैं। यह उन सभी के लिए किया जा सकता है, साथ ही साथ। AML वाले लोग जिनके पास कोई भी न्यूरोलॉजिकल लक्षण हैं, जो इस प्रसार का सुझाव दे रहे हैं।
एक काठ पंचर में, एक व्यक्ति घुटनों के बल और सिर नीचे करके एक मेज पर लेट जाता है। क्षेत्र की सफाई और सुन्न करने के बाद, एक डॉक्टर रीढ़ की हड्डी के आसपास और रीढ़ की हड्डी के आसपास के स्थान में, एक लंबी पतली सुई को निचली पीठ में डालता है। फिर द्रव को वापस ले लिया जाता है और विश्लेषण करने के लिए एक रोगविज्ञानी के पास भेजा जाता है।
लिम्फ नोड बायोप्सी
लिम्फ नोड बायोप्सी, जिसमें भाग या सभी लिम्फ नोड को हटा दिया जाता है, आमतौर पर ल्यूकेमिया के साथ किया जाता है। लिम्फ नोड बायोप्सी सीएलएल के साथ किया जा सकता है यदि बड़े लिम्फ नोड्स मौजूद हैं, या यदि आपको लगता है कि सीएलएल में तब्दील हो सकता है। एक लिंफोमा।
इमेजिंग
इमेजिंग परीक्षण आमतौर पर ल्यूकेमिया के लिए एक निदान पद्धति के रूप में उपयोग नहीं किया जाता है, क्योंकि रक्त संबंधी कैंसर जैसे ल्यूकेमिया अक्सर ट्यूमर नहीं बनाते हैं। हालाँकि, यह कुछ ल्यूकेमिया जैसे सीएलएल के लिए आवश्यक है।
एक्स-रे
एक्स-रे, जैसे छाती एक्स-रे या हड्डी एक्स-रे का उपयोग ल्यूकेमिया के निदान के लिए नहीं किया जाता है, लेकिन पहले संकेत दे सकते हैं कि कुछ गलत है। एक्स-रे में लिम्फ नोड्स का बढ़ना या हड्डियों का पतला होना (ऑस्टियोपेनिया) हो सकता है।
कंप्यूटेड टोमोग्राफी (सीटी स्कैन)
सीटी स्कैन शरीर के अंदर की 3-आयामी तस्वीर बनाने के लिए एक्स-रे की एक श्रृंखला का उपयोग करता है। सीटी छाती या शरीर के अन्य क्षेत्रों में नोड्स को देखने में सहायक हो सकती है, साथ ही प्लीहा या यकृत का विस्तार भी कर सकती है।
चुंबकीय अनुनाद इमेजिंग (MRI)
एक एमआरआई मैग्नेट का उपयोग शरीर के अंदर की तस्वीर बनाने के लिए करता है और इसमें विकिरण शामिल नहीं होता है। यह ल्यूकेमिया में मददगार हो सकता है जिसमें मस्तिष्क या रीढ़ की हड्डी शामिल होती है।
पोजीट्रान एमिशन टोमोग्राफी (पीईटी / सीटी या पीईटी / एमआरआई)
पीईटी स्कैन में, रेडियोधर्मी ग्लूकोज को शरीर में इंजेक्ट किया जाता है, जहां यह कोशिकाओं द्वारा लिया जाता है जो अधिक चयापचय रूप से सक्रिय होते हैं (जैसे कि कैंसर कोशिकाएं)। पीईटी ल्यूकेमिया की तुलना में ठोस ट्यूमर के साथ अधिक उपयोगी है, लेकिन कुछ पुरानी ल्यूकेमिया के साथ सहायक हो सकता है, खासकर जब लिम्फोमा में परिवर्तन के बारे में चिंता होती है।
विभेदक निदान
कुछ बीमारियां हैं, जो कम से कम प्रारंभिक परीक्षण के साथ, ल्यूकेमिया जैसी हो सकती हैं। इनमें से कुछ में शामिल हैं:
- कुछ वायरल संक्रमण: उदाहरण के लिए, एपस्टीन-बार वायरस (संक्रामक मोनोन्यूक्लिओसिस का कारण), साइटोमेगालोवायरस, और एचआईवी रक्त परीक्षणों पर एटिपिकल लिम्फोसाइटों की एक उच्च संख्या का कारण हो सकता है।
- मायलोयड्सप्लास्टिक सिंड्रोम: ये अस्थि मज्जा की बीमारियां हैं जो एएमएल में विकसित होने के लिए एक पूर्वाभास हैं और कभी-कभी प्रीलेक्मिया के रूप में संदर्भित होती हैं।
- माइलोप्रोलिफ़ेरेटिव विकार: पॉलीसिथेमिया वेरा, आवश्यक थ्रोम्बोसाइटोसिस, प्राथमिक मायलोफिब्रोसिस, और अधिक जैसे लक्षण इन-डेप्थ परीक्षण विधियों के प्रदर्शन से पहले ल्यूकेमिया से मिलते जुलते हो सकते हैं।
- अप्लास्टिक एनीमिया: एक ऐसी स्थिति जिसमें अस्थि मज्जा सभी प्रकार की रक्त कोशिकाओं को बनाना बंद कर देती है।
मचान
एक बार ल्यूकेमिया की पुष्टि हो जाने के बाद, इसका मंचन अवश्य किया जाना चाहिए। स्टेजिंग एक कैंसर को वर्गीकृत करने के लिए डॉक्टरों द्वारा उपयोग की जाने वाली प्रणाली को संदर्भित करता है। एक कैंसर के चरण का निर्धारण, सामान्य रूप से, डॉक्टरों को सबसे उपयुक्त उपचार का चयन करने में मदद कर सकता है और साथ ही रोग के पूर्वानुमान का अनुमान लगा सकता है।
स्टेजिंग विभिन्न प्रकार के ल्यूकेमिया के बीच भिन्न होता है। चूंकि कई ल्यूकेमिया ठोस द्रव्यमान नहीं बनाते हैं, इसलिए स्टेजिंग (सीएलएल के अपवाद के साथ) स्तन कैंसर या फेफड़ों के कैंसर जैसे ठोस ट्यूमर से बहुत अलग है।
एक चरण को निर्दिष्ट करने में कई अध्ययनों पर ध्यान दिया जा सकता है, जैसे कि रक्त या अस्थि मज्जा में पाए जाने वाले अपरिपक्व श्वेत रक्त कोशिकाओं की संख्या, ट्यूमर मार्कर, गुणसूत्र अध्ययन, और बहुत कुछ।
जब मंचन को देखते हैं, तो यह ध्यान रखना महत्वपूर्ण है कि ल्यूकेमिया बीमारियों की एक विस्तृत श्रृंखला है। एक ही तरह के ल्यूकेमिया वाले दो लोग और एक ही चरण में चिकित्सा के लिए बहुत अलग प्रतिक्रियाएं हो सकती हैं, साथ ही साथ अलग-अलग संभावनाएं भी हो सकती हैं।
क्रोनिक लिम्फोसाइटिक ल्यूकेमिया (CLL)
क्रोनिक लिम्फोसाइटिक ल्यूकेमिया के लिए, विभिन्न स्टेजिंग सिस्टम हैं जिनका उपयोग किया जा सकता है। सबसे आम राय प्रणाली है। इस प्रणाली में, कई निष्कर्षों की उपस्थिति के आधार पर ल्यूकेमिया को चरण 0 और चरण 4 के बीच एक चरण दिया जाता है:
- लिम्फोसाइटों की उच्च संख्या
- बढ़े हुए लिम्फ नोड्स
- एक बढ़े हुए जिगर और / या प्लीहा
- रक्ताल्पता
- प्लेटलेट्स का कम स्तर
इन चरणों के आधार पर, कैंसर को निम्न, मध्यवर्ती और उच्च जोखिम वाली श्रेणियों में विभाजित किया जाता है।
इसके विपरीत, यूरोप में उपयोग की जाने वाली Binet प्रणाली इन ल्यूकेमिया को केवल तीन चरणों में अलग करती है:
- स्टेज ए: 3 लिम्फ नोड्स से कम
- स्टेज बी: 3 से अधिक प्रभावित लिम्फ नोड्स
- स्टेज सी: लिम्फ नोड्स की कोई भी संख्या, लेकिन एनीमिया या प्लेटलेट्स के निम्न स्तर के साथ।
तीव्र लिम्फोसाईटिक ल्यूकेमिया (ALL)
तीव्र लिम्फोसाइटिक ल्यूकेमिया के लिए, स्टेजिंग अलग है, क्योंकि रोग ट्यूमर द्रव्यमान नहीं बनाता है जो मूल ट्यूमर से वृद्धिशील रूप से विस्तारित होता है।
सभी का पता चलने से पहले ही अन्य अंगों में फैल जाएगा, इसलिए पारंपरिक मंचन विधियों का उपयोग करने के बजाय, चिकित्सक अक्सर सभी और व्यक्ति की आयु के उपप्रकार में कारक होते हैं।
इसमें आमतौर पर साइटोजेनेटिक टेस्ट, फ्लो साइटोमेट्री और अन्य लैब टेस्ट शामिल होते हैं।
चरणों का उपयोग करने के बजाय (अतीत में उपयोग किए जाने वाले बड़े पैमाने पर अप्रचलित हैं), बीमारी के "चरणों" द्वारा सभी को अक्सर परिभाषित किया जाता है। इनमें शामिल हैं:
- अनुपचारित सभी
- सभी छूट में
- न्यूनतम अवशिष्ट रोग
- दुर्दम्य ALL
- विमोचित (आवर्तक) सभी
एक्यूट मायलोजेनस ल्यूकेमिया (AML)
सभी के समान, तीव्र मायलोजेनस ल्यूकेमिया का आमतौर पर पता नहीं लगाया जाता है जब तक कि यह अन्य अंगों तक नहीं फैलता है, और इसलिए पारंपरिक कैंसर स्टेजिंग लागू नहीं होता है। स्टेजिंग ल्यूकेमिया के उपप्रकार, एक व्यक्ति की उम्र और अधिक जैसी विशेषताओं से निर्धारित होती है।
एक पुरानी स्टेजिंग प्रणाली, फ्रेंच-अमेरिकन-ब्रिटिश (एफएबी) वर्गीकरण, एएमएल को माइक्रोस्कोप के तहत कोशिकाओं की उपस्थिति के आधार पर, एम 7 के माध्यम से आठ उपप्रकारों में वर्गीकृत किया गया है।
विश्व स्वास्थ्य संगठन (डब्ल्यूएचओ) ने रोग के पूर्वानुमान की अधिक बारीकी से भविष्यवाणी करने की उम्मीद के साथ एएमएल मंचन के लिए एक अलग प्रणाली विकसित की।
इस प्रणाली में, इन ल्यूकेमिया को कोशिकाओं में गुणसूत्र संबंधी असामान्यताओं के रूप में अलग किया जाता है (कुछ गुणसूत्र परिवर्तन बेहतर-औसत-औसत रोग से जुड़े होते हैं, जबकि अन्य खराब परिणामों से जुड़े होते हैं), चाहे कैंसर कीमोथेरेपी के बाद उत्पन्न हुआ हो या नहीं विकिरण (माध्यमिक कैंसर), जो डाउन सिंड्रोम से संबंधित हैं, और बहुत कुछ।
क्रोनिक माइलोजेनस ल्यूकेमिया (CML)
क्रोनिक माइलॉयड ल्यूकेमिया के लिए माइलॉयड वंश (जैसे न्यूट्रोफिल) से संबंधित परिपक्व कोशिकाओं की बढ़ी हुई संख्या की उपस्थिति आम है। स्टेजिंग परिपक्वता के विभिन्न चरणों में अपरिपक्व माइलॉयड कोशिकाओं की संख्या के आधार पर निर्धारित की जाती है:
- जीर्ण चरण: इस प्रारंभिक चरण में, रक्त या अस्थि मज्जा में 10 प्रतिशत से कम विस्फोट होते हैं और लक्षण या तो हल्के या अनुपस्थित होते हैं। CML के पुराने चरण के लोग आमतौर पर उपचार के लिए अच्छी प्रतिक्रिया देते हैं।
- त्वरित चरण: अगले चरण में, रक्त या अस्थि मज्जा में 10 प्रतिशत से 20 प्रतिशत कोशिकाएं विस्फोट होती हैं। लक्षण अधिक स्पष्ट हो जाते हैं, विशेष रूप से बुखार और वजन कम होता है। परीक्षण फिलाडेल्फिया गुणसूत्र के अलावा नए क्रोमोसोमल परिवर्तनों को प्रकट कर सकता है। CML के त्वरित चरण में लोग उपचार का जवाब नहीं दे सकते हैं।
- ब्लास्ट चरण (आक्रामक चरण): सीएमएल के ब्लास्ट चरण में, रक्त या अस्थि मज्जा में 20 प्रतिशत से अधिक कोशिकाएं विस्फोट होती हैं, और ब्लास्ट कोशिकाएं अस्थि मज्जा के बाहर शरीर के क्षेत्रों में भी फैल सकती हैं। इस चरण के दौरान लक्षणों में थकान, बुखार और बढ़े हुए प्लीहा (ब्लास्ट संकट) शामिल हैं।